
化學課程報名系統
(線上/實體課程)


Sam Chai 化學課程 2023 DSE S6 Intensive Course



🟠🟠Sam Chai 化學課程 2023 DSE S6 Intensive Course🟠🟠
⚠️2023 DSE 皇牌 S6 精讀班,現已接受報名!
Ultimate Live 名額有限,去年極速爆滿,同學欲報從速!
👑 戰績經驗 傲視同儕
🔥 教學熱誠 無容置疑
⭐️技巧。貼題。一應俱全⭐️
⚡️Inspired Learning Ultimate Live (太子 / 銅鑼灣) 3 大最強配套
1️⃣ 每堂即場小測
✏️題目針對改善同學概念,並以貼題為主
✏️每份測驗均由 Sam Chai 親自批改
✏️給予同學個別評語和指導
✏️務求短期內顯著提升同學考試狀態
2️⃣ 每期一個模擬測驗 Mock Test
✏️總結每期學習進度
✏️題目具挑戰性,針對同學常犯錯誤
✏️適合目標為 Level 5 或以上同學
✏️令同學及早發現自己需要改善的地方
3️⃣ 每期一堂額外實驗影片
✏️由於2023 DSE 繼續取消 SBA,參考2021 和 2022 DSE,試卷比以往包含較多實驗元素的題目
✏️全面涵蓋課程內所有指定實驗
✏️彌補同學在實驗知識方面的不足
———
✅四個月內,令你表現極速提升,起死回生
✅追回過去三年進度,涵蓋課程各個必考重點
✅預測2023 DSE Paper 1 大熱課題和必讀部分
✅被學生譽為「最強釐清概念之課程」
✅筆記每年更新,中英對照
📝 精讀班不包括 Paper 2 課題,同學可選報常規課程 (分校 VIP 課程)
🚨 課程只接受合資格 2023 DSE 考生報讀
——
🚨三大必報原因!
一、課程重大修改
2021 Chem 的課程作出修改,與 2016 – 2020 的第二版本課程相比,這個第三版本的課程共有多達25處的改動和更新,包括大量全新實驗。
若然沒有讀過,考生做卷時就只能直接投降和浪費大量時間理解。
二、缺乏考試準備
過去三年的疫情,令學生大多只需進行單向式網上課堂或半天的面授課堂。
可是,DSE 的課程是根據全日制學制編寫,但考試範圍依舊,學生根本無法徹底消化。
在日校課堂上,為了讓學生能夠掌握課程的基本要求,老師往往只能放棄一些較深入的內容和實驗。
三、一試定生死
取消 SBA 校本評核,兩份試卷分數按比例上調 1.25 倍,導致同學失分壓力大增。
面對 2022 DSE 接近 93% 5** 的 cut-off 分數,失分空間極少。
你還敢輕視這個考試嗎?
精讀課程
常規課程
熱門課程
常規課程
名師介紹
學歷雄厚 化學專才
- 中學畢業於傳統名校喇沙書院,會考獲得 5A4B 佳績,在會考和高考的化學科中取得優良成績。
- 大學畢業於美國十大研究型大學之一的明尼蘇達雙城大學 (University of Minnesota, Twin Cities, USA),雙主修 (Double Major) 化學工程 (Chemical Engineering) 及生物化學 (Biochemistry),雙副修 (Double Minor) 化學 (Chemistry) 及生物 (Biology),資歷冠絕一般理工科本科畢業生。
- 在能夠成功挑戰這項艱鉅任務的同時,Sam在大學選修的各種課程中均取得上等成績,並獲得校方的嘉許,8 個學期內 5 度獲得 Dean’s List Award 和兩次工程系獎學金獎項,並以榮譽畢業,成就斐然。
- 期間更被大學校方邀請擔任兩個學期的生物化學課程助教導師,其教學能力和熱誠獲得大學校方的絕對肯定。
- 曾參與大學內多項生物化學工程的大型研究計畫,獲得三次由大學頒發的研究獎項,並有份參與刊登在世界知名的科學雜誌上的論文之寫作工作,學術能力和科學觸覺無容置疑。
口碑戰績 傲視同儕
- 在 10 多年的教學生涯中,5** / 5* 學生人數眾多,奪星比例極高,學生中有多名 3 科 5** 或以上成績。
- 歷屆 DSE 多名狀元之選,其中於 2014、2016、2017 和 2018 年均為 7 科 5** 狀元信心之選,2015 和 2019 年則為 6 科 5** 狀元之選,經驗和戰績冠絕香港化學補習界。
- 歷年來成功幫助多位自修生升 grades 奪星:4 → 5** (2013 和 2016)、5* → 5** (2015 – 2019)、4 → 5* (2016 – 2020)、3 → 5* (2014 – 2017、2019),令重讀的同學順利考入心儀學科。
- 所有學生親身見證,歷屆 DSE 多次成功預測試題,最新於 2021 DSE 完全準確貼中 Paper 1 2 條 essays 和超級高難度一模一樣貼中 Paper 2 Mass Spectrum (質譜),有圖為證絕不取巧。
技巧獨到 多不勝數
- 公認化學科考評專家,獨家技巧一向是幫助學生於考試中致勝的關鍵。
- 獨具匠心,糅合了多年來學習化學的心得和觸覺,獨創一套「化學強化記憶法」,著重學生對概念的掌握和理解,減少大量缺乏系統的死記背誦,令學生知識與技巧並重。
- 一向善於令本來成績未如理想或程度較低的學生,重拾對化學的興趣和信心,並於短時間內顯著提升在校內試和公開試的表現。
筆記練習 緊貼課程
- 筆記精闢,排版清晰,選材合適,貼近考評局的課程指引,詳盡囊括 2021 年版本 DSE 新課程的每一個考點,絕對不會令學生浪費時間溫習課程以外的資料。
- 筆記中英對照,配合堂上的生動講解,必定釐清一切概念。
- 近年評分準則越趨嚴謹,筆記和練習不斷更新,堂上測驗也不斷加入獨創新題型。
- 配合獨家皇牌詳盡題解分析 (Suggested Solutions),令學生徹底掌握出題手法和評分準則,熟悉相關答題技巧,輕易化解設題陷阱及避免犯上常見錯誤。
- 為應付 DSE 的新題型,參考多個外國公開試(例如 GCEAL、IB、IGCSE、CIE、SPM、O-Level)、美國多個大學入學試 (例如SAT、ACT、AP) 和內地不同省份高考的教材。
親力親為 獨立配套
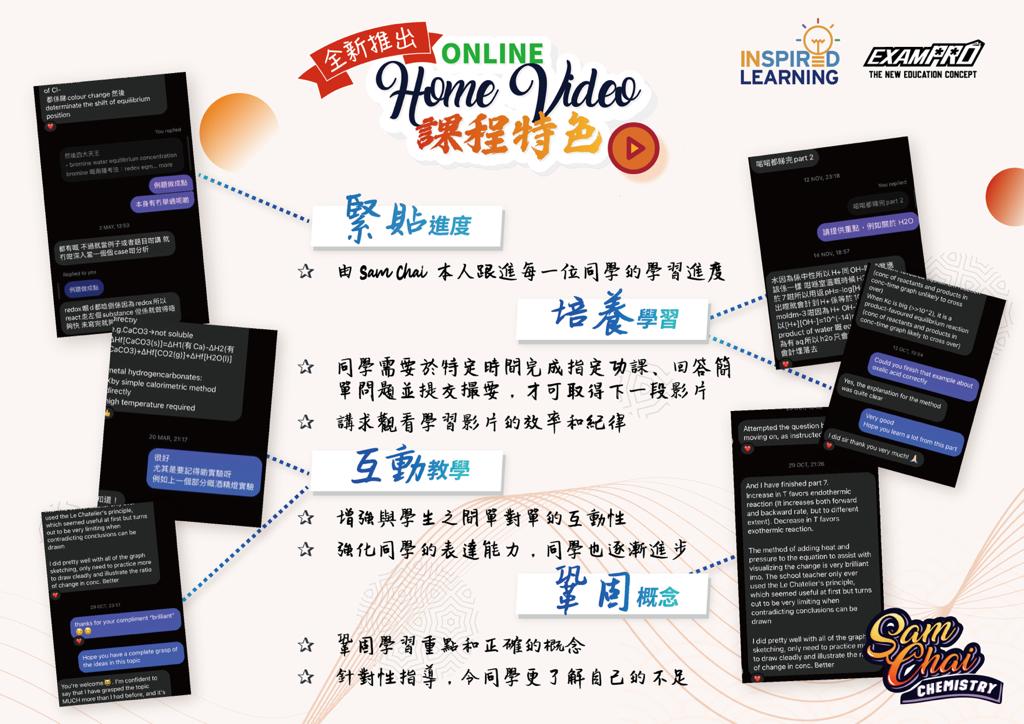
- 著重與學生互動,務求了解每一位同學的學習需要。
- 即使是 Home Video 課程,也要求每一位同學報告進度、完成練習和回答問題,並全部親自回覆,個人化訂造配套絕對超出一般小型補習或私補水平。
- 一絲不苟,絕不假手於人,親自批改每一份練習、測驗和模擬考試卷,並親身給予每一位學生最貼身的評語和指導。
- 有問必答,全方位提供堂後免費預約問書環節、Instagram、Facebook、WhatsApp 給學生隨時在課餘時間詢問問題,迅速詳細回覆。
學生感想

尹穎彤 6科5**狀元
多謝Sam Chai喺中六最後階段幫我有效率+全面重溫成個DSE Chemistry syllabus,令我安心,有信心進入考場
課堂上很多讓我也了解考試traps既地方,對摘星有好大幫助~同時past paper既solution真係非常詳盡,不但令我明白果一題,同時清到concepts。Loads of thanks!

Lee Ka Wing 6科5**狀元

Ng Wai Chung 6科5**狀元

余天慧 5** 聖保羅男女中學
化學科5**
雖然淨係補咗Sam Chai一年,原本亦只係諗住求其試吓堂咁,但係一年之後先發現Sam Chai既堂帶比我既並唔單只係Chem上面既知識,更多既係做人既態度。其實我本身對Chem呢科係0興趣,係學校上Chem堂每堂都訓覺,但係開始補咗Sam Chai之後,可能因為佢會搞吓gag(雖然有時d gag好爛),慢慢就覺得其實Chem都幾有趣,溫書既時候會諗翻起啲,都無咁悶。做到呢樣野既老師真係唔多,而且係搞笑既同時我地亦認真學到好多野,而且筆記每一頁都係精華,完全無多餘既野,只要開始補咗Sam Chai就唔會想睇textbook/其他筆記 J 可能有人會覺得呢啲都係補習老師既本份,但係我相信無其他老師可以比得上佢認真,同埋有心既程度,試問有邊一個老師會24小時facebook message答問題,又肯每一堂chur到嘔都陪學生overrun,exercise又highlight曬啲重點題目,又sort埋ALAS啲題目落ex.度,仲有好多係點未能一一盡錄 :p但總之所有補過佢既學生都會
明白Sam Chai既好,明白佢日日爆肝做notes都係為咗啲學生,好似佢最後果堂咁講,佢一定無對唔住啲學生,無對唔住自己,Sam Chai值得人欣賞既地方唔淨只係佢Chem上面既知識(Sam Chai真係好叻 J),更加係佢一路以黎都堅守自己原則,可能有人會話佢寸,對學生差,但係對我黎講Sam Chai已經唔係補習老師,而係一個朋友,好多謝佢帶比我既所有野,如果唔係Samson,我可能已經放棄咗Chem呢科。多得佢,我先有動力考好呢一科,亦都得到意想唔到既好成績,最重要既係,多咗個人生導師,同埋多咗個朋友 Thank you so much SamSam <3

劉俊達 4→5** 自修生
Sam Chai既筆記內容可以提高學習效率,縮短溫習時間,讓我能在有限時間溫最多既野。課堂氣氛十分愉快。齊老師好野!!!

Maggie Lam 5** Diocesan Girls’ School
對於Chem這一科欠缺信心,甚至感到絕望的同學,選擇 Samson作為化學科補習老師是唯一可行的方法^V^即使本身喜愛此科的同學(如我),有時亦有讀不得其法的時候。上了Samson的化學堂,不但令我輕鬆記得及透徹明白很多繁複的概念,更令我充滿信心走進試場,並帶着滿意的笑容離開^V^
Thank you Samson for giving me the chance to grab the two stars with such ease and confidence ^V^ I’ve enjoyed every second in your lessons
最後講番句老套野,識補Chem,一定係補Sam Chai ^V^

呂靄昕 5** 港島民生書院
多謝Sam Chai三年嚟既教導!上堂講咗好多可以應用喺日常生活既Chem知識,令我對Chem產生咗好大既興趣。仲有好多DSE既細節位都講得好清楚,考DSE好有信心XD師弟妹記住上堂答多啲問題哈!

嚴淇諾Yim Ki Nok 5* Pui Ching Middle School
Sam Chai係個超級熱血的老師,佢個份熱血令我由一個take Chem係為咗drop Chem既人愛上咗Chem呢科。Sam Sir都係一個好有實力既老師,我由報之前Chem既成績係次次唔合格到今時今日Chem攞到5*都算係奇蹟。Sam Sir仲係一個凡事親力親為,好關心學生既人,除咗課後俾我地無限係Facebook問問題外,堂堂overrun不在話,而且都注重學生既品格修養 Love Sam Sir

Henry Ma 5* St. Paul’s College
自問向來對興趣不大,主要因為需背誦大量內容而感到生厭。自從補咗Sam Chai,佢既口訣同有趣既教法令我重拾信心,對於一D較抽象既概念,佢既比喻同例子都令我對作答更為得心應手。即使放榜已久,佢第一堂教既內容我依然歴歴在目,可見Sam既教法令我記憶更深。所以補咗Sam Chai三年既我十分感激Samson對我既幫助,令我喺Chem攞到不俗既成績,重拾翻讀書既信心,成功入到心儀既大學科目!Thank a lot, Sam! From Henry Ma

劉震宇 自修生 5 → 5** 自修
作為一個自修生,升分實在不易,上年我既成績係5,自問已有唔差既concepts理解,因此不太清楚自己可進步既地方,但自從上了你堂才發現自己有好多野溫漏咗,亦有好多細微既位理解錯或唔夠清楚,上你既堂完全解決以上問題。
P.S. 希望可以keep contact!!!
我的5**是我的亦是你的!希望你能保持教學熱誠,在引導迷途小羔羊的同時,向他們灌輸人生道理!

黃家威 自修生 4 → 5* 沙田蘇淅公學
Sam Chai,我係一個DSE retaker,上一年拎4本來真係對Chem呢一科冇晒信心,直情就算retake都唔諗住take呢科。之後補左你一個月,明左好多野,以前真係好有挫敗感,之後做mock發現concepts通左好多。最後係有信心下考到5*!你令到我今年條路光明左,因為成績進步令自信心高左,更勇敢面對人。多謝!
你就係今年的明燈,多謝你份教書熱誠!

梁芷晴 5
多謝你呀Sam Chai!由學校predict我拿4到依家有5真係要多謝你,雖然上你堂成日overrun,但正正因為咁我哋呢班學生先可以學到咁多有用既Chem知識!仲要多謝你上堂怕我哋悶所以成日搞gag,令我哋補習變得更加有趣XD同埋你會帶部iPad俾我地睇唔同experiment既做法,令我哋可以更加清楚了解每個示範既細節,多謝你呀

曾雋滐 5**
我個人認為Sam Chai課程最好既地方係佢旨在減少背誦內容,改為用口訣記野 (e.g. solubility rule)。而且每個topic都會附有相關past paper既mc同LQ,仲要附上有explanation既答案!除左教學內容豐富,我都好佩服Sam Chai既教學熱誠,試問宜家有幾多老師仲會堂堂親身Live而唔請助教?而且,每堂都會overrun,唔係因為教得慢,而係想教多啲野。

陳凱琳 5
多謝Sam Chai!由學校pre我得2變到最後攞5!By topic past paper雖然有好多,但全部都超級有用!黃色本解釋幫咗我好多,令我更加明白同深刻。RED CAT ANOX呢D口訣都令我記少咗好多野XD。Thank you Sam Chai!<3

施振睿 5*
Sam Chai既anchem實在令我獲益良多!本身anchem底子比較差,但Sam Chai既教學好concept-based,會慢慢幫你build up返成個topic既concept,佢亦成日會提返D考生常犯既misconceptions/careless mistakes去幫助我地avoid呢D犯錯,每次上堂都會有學到新野/鞏固左知識既感覺。臨考DSE前都有溫返佢啲簡而精既notes去recap返個curriculum!多謝Sam Chai既用心教學!

許芷嘉 5*
中三中四既Chem一直都唔合格,成績係級下遊,成日都唔明啲背後原理,中五嗰時覺得自己個底咁差,想drop咗Chem,後尾見到啲人話Sam Chai教得好好就去試下,佢上堂個時成日都好細心咁講解,有啲複雜或重要位會講幾次,又會提我地邊啲地方要留意唔好錯,幫到我清好啲concept,講書又好風趣間唔中講下啲笑話又有啲口訣幫我地背野,令到讀Chem呢個過程冇咁沈悶,另外仲俾好多resources我地,啲PP好齊分晒topic方便我溫書同操卷。Sam Chai真係幫咗我好多,多謝晒!
















